云准医药科技(上海)有限公司
入驻年限:5 年
- 联系人:
刘女士
- 所在地区:
上海 徐汇区
- 业务范围:
技术服务、耗材、实验室仪器 / 设备、抗体、试剂
- 经营模式:
生产厂商 代理商
推荐产品
公司新闻/正文
经典案例合集 | 除了PD-L1, 肺癌标志物还可结合这些
人阅读 发布时间:2023-01-30 17:47
肺癌是全球发病率和死亡率的来源, 也是在中国最常见的癌种之一[1]。在过去的二十年里,医学研究者们已经认识到肺癌患者的多样性。患者个体的多样性是病理生物学异质性的基础,对疾病预后和治疗选择有重要影响。
肺癌特别是具有“非小细胞”组织学 ,可以广泛地分为有明确的致癌基因和超突变基因[2]。前者包括EGFR,MET,BRAF,ALK,ROS1,RET,ERBB2和 NTRK1-3突变的肿瘤,可能对致癌活化蛋白的特异性抑制剂有反应。后者倾向于表现出 MAPK 途径依赖性,表现为肿瘤突变负荷(TMB)升高和产生突变相关新抗原的可能性增加。
自从免疫肿瘤学(IO)的发展以来,肺癌的医学治疗已经发生了不可逆转的变化,包括针对 PD-1,PD-L1和 CTLA-4的免疫检查点抑制剂的使用,形成了大多数非小细胞肺癌患者肿瘤治疗的重要方案。然而,对这些疗法的个体反应差异很大,从完全解决转移性疾病和长期缓解的患者,到那些尽管使用新的检查点抑制剂但迅速进展并死于癌症的患者。
虽然免疫组织化学的 PD-L1蛋白表达作为免疫治疗反应的主要预测性生物标志物,但这种方法的灵敏度和特异性都不是最佳的,临床 PD-L1测试受到不同伴侣诊断测定增殖所产生的结果重现性和混淆的困扰。富集策略,以更好地选择那些更有可能有反应的患者,已经确定免疫组织化学的 PD-L1染色(IHC)是治疗初始和难治性患者的预测性生物标志物。这一策略存在许多挑战,需要进一步探索更可靠的生物标志物,包括肿瘤突变负荷、包括肿瘤浸润性淋巴细胞和免疫评分在内的“发炎表型”、 T 细胞受体克隆性、基因特征和一些血浆生物标志物。
与此同时,对肿瘤和宿主免疫特异性因素的深入了解,为预后和反应预测提供了依据,正开始定义更好的免疫治疗生物标志物。除了免疫检查点表达状态外,免疫治疗反应预测分析的常见主题包括癌症新抗原产生、肿瘤和抗原呈递细胞中的抗原呈现通路状态、肿瘤微环境中效应和抑制性免疫细胞的混合物,以及可能影响所有这些变量的基因组驱动因素和计算。检测肿瘤中免疫细胞的不同技术,如多重免疫荧光,RNA-seq,DNA 甲基化模式等,都可以用于分析肺癌异质性、预测因子对药物治疗肺癌反应的重要研究工具。
多重免疫荧光(mIF)方法最近以非常快的速度取得了进展。粗略的文献检索显示,从2014年到撰写本综述时,与2014年之前的十年相比,使用mIHC 的研究数量大致相同。循环染色和猝灭、抗体-分析物结合、分析物检测和可视化的新方法,如PhenoCycler-Fusion, 允许在单个组织切片中对可能超过100种蛋白质进行空间识别。
此外,应用核酸化学,结合空间转录组技术,同时对样本中的蛋白、转录组信息进行深度挖掘,在空间背景下进行分析。使信息最大化的驱动力正在演变成一种“多组学”方法,这种方法结合了从单个组织切片中确定蛋白质组学、转录组学和基因组学特征的技术。以PhenoImager 多重免疫荧光为代表的mIHC作为一种新技术,在很多相关临床研究中都有重要应用,以期找到可以应用于肺癌临床治疗、更准确预测患者个体差异的生物标志物。以下汇总了一些近年肺癌研究的相关案例,供各位读者参考。
案例一
题目:Neoadjuvant atezolizumab and chemotherapy in patients with resectable non-small-cell lung cancer: an open-label, multicentre, single-arm, phase 2 trial
期刊:The Lancet Oncology,2020
主要技术:
1)在肿瘤组织样本中,使用PhenoImager 多重免疫荧光,描述治疗前后肿瘤活组织检查中的免疫微环境 ;分析免疫肿瘤和代谢相关基因的 mRNA 水平;利用组织上的下一代测序(NGS)来鉴定 TCR 基因座的克隆性。
2)在血液样本中,使用下一代测序技术(NGS)对 PBMC 进行 TCR 基因座克隆性鉴定。分析患者血浆和健康对照组肿瘤微环境分泌的160种细胞因子的水平,分析患者血液中 cfDNA 的突变情况。
标志物方案:
Panel 1
CD3
T细胞
CD8
杀伤性T细胞
PD-1
免疫抑制分子
PD-L1
免疫抑制剂反应
CD68
巨噬细胞
pan-CK
肿瘤细胞
Panel 2
CD3
T细胞
CD8
杀伤性T细胞
FOXP3
调节性T细胞
granzyme B
细胞毒性淋巴细胞
CD45RO
记忆T细胞
pan-CK
肿瘤细胞
这项研究在 clinicaltrials.gov NCT02716038注册。大约25% 的非小细胞肺癌患者存在可切除的 IB-IIIA 期疾病,尽管围手术期化疗是护理的标准,但这种治疗策略仅提供适度的生存益处。
基于免疫检查点抑制剂在转移性非小细胞肺癌中的活性,研究者设计了一项试验来测试 PD-L1抑制剂 atezolizumab 与carboplatin 、 nabpaclitaxe联用,作为手术切除前新辅助治疗的活性。该方法在美国三家医院进行开放标签、多中心、单臂、二期临床试验,主要终点是主要的病理反应,定义为在手术时存在10% 或更少的残余存活肿瘤。研究结果在2016年5月26日至2019年3月1日期间,研究者评估了39名患者的资格,其中30名患者入选。其中23例(77%)患有 IIIA 期疾病。29例(97%)进入手术室,26例(87%)成功行 R0切除。数据截止时间(2019年8月7日) ,中位随访时间为12.9个月(IQR 6.2-22.9)。30例患者中有17例(57% ; 95% CI 37-75)有明显的病理反应。
上述结果提示Atezolizumab 加卡铂和纳他紫杉醇可能是可切除的非小细胞肺癌的潜在新辅助方案,高比例的患者达到主要病理反应,可控的治疗相关毒性作用,这不影响手术切除。
案例二
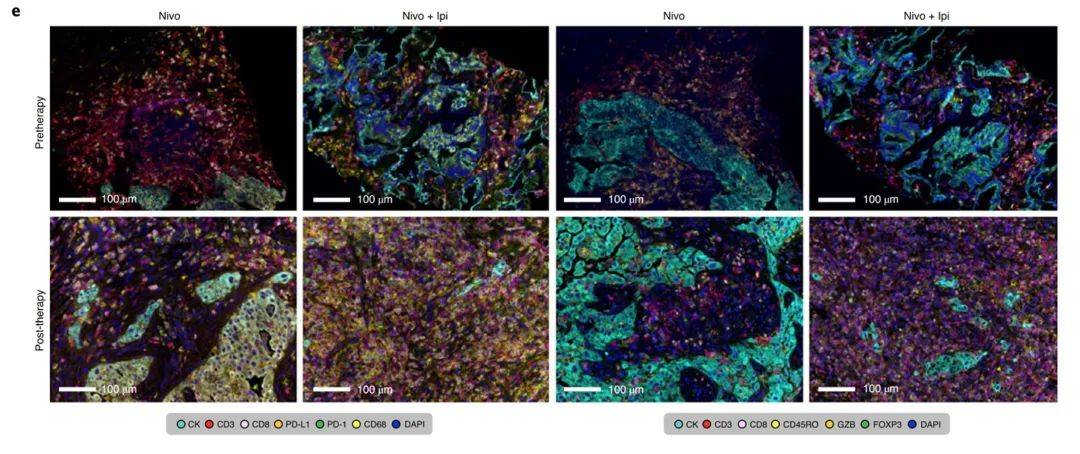
题目:Neoadjuvant nivolumab or nivolumab plus ipilimumab in operable non-small cell lung cancer: the phase 2 randomized NEOSTAR trial
期刊:Nature Medicine,2021
主要技术:
使用PhenoImager 多重免疫荧光、 多色流式技术、PD-L1 免疫组化描述治疗肿瘤样本中免疫细胞比例、分布和状态。使用组织上的下一代测序(NGS)来鉴定 TCR 克隆性
标志物方案:
使用了与案例一中同样的两个Panel:
Panel 1:CD3、CD8、PD-1、PD-L1、CD68、pan-CK
Panel 2:CD3、CD8、FOXP3、granzyme B、CD45RO、pan-CK
Ipilimumab 联合 nivolumab 治疗转移性非小细胞肺癌(NSCLC)可改善临床预后,但其在可手术 NSCLC 中的疗效和对免疫微环境的影响尚不清楚。这项研究中展示了新辅助 nivolumab 或 nivolumab + ipilimumab 的2期随机 NEOSTAR 试验(NCT03158129)的结果,随后以主要病理反应(MPR)作为主要终点,对44例可手术的 NSCLC 患者进行手术。
每个治疗组的 MPR 率与新辅助化疗的历史对照进行比较。Nivolumab + ipilimumab 组在21例患者中达到了预先设定的6个 MPR 的主要终点阈值,达到了38% 的 MPR 率(8/21)。其中 nivolumab 组的 MPR 率为22% (5/23)。在37例试验切除的患者中,nivolumab 和 nivolumab + ipilimumab 的 MPR 率分别为24% (5/21)和50% (8/16)。与 nivolumab 相比,nivolumab + ipilimumab 导致更高的病理完全缓解率(10% 比38%) ,存活率较低的肿瘤(中位数50% 比9%) ,效应器,组织驻留记忆和效应记忆 T 细胞的频率更高。肠道瘤胃球菌和阿克曼球菌丰度的增加与 MPR 双重治疗有关。
研究数据表明,新辅助 nivolumab + ipilimumab 为基础的治疗增强了病理反应,肿瘤免疫浸润和免疫记忆,值得进一步研究可手术的非小细胞肺癌。
案例三
题目:Immune evolution from preneoplasia to invasive lung adenocarcinomas and underlying molecular features
期刊:Nature Communications,2021
主要技术:
使用转录组免疫分析、 T 细胞受体(TCR)测序和多重免疫荧光来描述侵袭性肺 ADC 及其前体的免疫环境
标志物方案:
使用了与案例一、二中同样的两个Panel:
Panel 1:CD3、CD8、PD-1、PD-L1、CD68、pan-CK
Panel 2:CD3、CD8、FOXP3、granzyme B、CD45RO8、pan-CK
抗癌免疫形成肺腺癌(ADC)早期癌变的机制尚不清楚。研究结果表明,抗肿瘤免疫作为一个连续体从肺癌前病变,到预侵袭性 ADC,微创性 ADC 和坦率侵袭性肺 ADC,具有逐渐降低的有效性和更强烈的调节免疫应答,包括免疫激活途径的下调,免疫抑制途径的上调,细胞毒性 T 细胞(CTL)和抗肿瘤辅助性 T 细胞(Th)的较低浸润,调节性 T 细胞(Tregs)的较高浸润,T 细胞克隆性降低和后期 T 细胞克隆频率较低。驱动突变,染色体拷贝数畸变(CNA)和异常 DNA 甲基化可能共同影响宿主免疫应答并促进免疫逃避,促进肿瘤前期拟合亚克隆向侵袭性 ADC 中的显性克隆的生长。
案例四
题目:A proteogenomic portrait of lung squamous cell carcinoma
期刊:Cell, 2021
主要技术:
基于阵列的甲基化分析、RNA 和 miRNA 测序、质谱法、免疫组织化学(IHC)和PhenoImager多重免疫荧光
标志物方案:
Panel
Cytokeratin
肿瘤细胞
Alpha-SMA
肿瘤细胞
研究亮点 (1)无监督聚类显示有EMT和磷蛋白特征的亚型 ; (2)潜在的治疗漏洞包括survivin、NSD3、LSD1和EZH2 ; (3)Rb磷酸化被提名为CDK4/6抑制剂试验的生物标志物; (4)详细的免疫景观分析突出了免疫调节的靶点。
研究者描述了肺鳞状细胞癌(LSCC)的蛋白质组景观,提供了一个更深入的阐述 LSCC 生物学与潜在的治疗意义。
这项研究确定了 NSD3作为 FGFR1扩增肿瘤和过表达治疗靶生存素的低 p63肿瘤的替代驱动因子。SOX2被认为是不可药物治疗的,但是这个研究的分析为探索染色质修饰物如 LSD1和 EZH2以靶向 SOX2过表达的肿瘤提供了理论基础。支持通过包括泛素化在内的翻译后修饰之间的串扰对代谢途径进行复杂的调节。许多免疫相关的蛋白质组学观察为进一步研究提供了方向。CDKN2A 突变的蛋白质基因组解剖争论在宣布 CDK4/6抑制失败之前对 RB1蛋白表达和磷酸化进行更细致的评估。最后,在 LSCC、 LUAD 和 HNSCC 之间的三角测量确定了独特和常见的治疗弱点。这些观察和蛋白质基因组学数据资源可以指导 LSCC 的生物学和治疗研究。
案例五
题目:Association of High Tumor Mutation Burden in Non–Small Cell Lung Cancers With Increased Immune Infiltration and Improved Clinical Outcomes of PD-L1 Blockade Across PD-L1 Expression Levels
期刊:JAMA Oncology, 2022
主要技术:
空间转录组、PhenoImager多重免疫荧光
标志物方案:
Panel
CD8
杀伤性T细胞
PD-1
免疫抑制分子
PD-L1
免疫抑制剂反应
FOXP3
调节性T细胞
这样研究的目标是确定非小细胞肺癌患者 TMB 水平升高与临床相关程序性死亡配体 -1(PD-L1)水平的免疫治疗效果之间的关系。研究者对多中心队列研究包括接受免疫治疗的晚期非小细胞肺癌患者,针对TMB 水平与客观缓解率(ORR) ,无进展生存期(PFS)和总生存期(OS)的关系进行评估。
在接受 PD-1/PD-L1阻断治疗的1552例晚期非小细胞肺癌患者的整个队列中,中位(范围)年龄为66(22-92)岁,830(53.5%)为女性,1347(86.8%)患有非鳞状组织学特征的癌症。回归树模型 ORR 作为 TMB 的函数在发现队列(MSKCC)中鉴定了2个 TMB 组,这些 TMB 水平也与每个 PD-L1肿瘤比例评分小于1% ,1% 至49% 和50% 或更高的亚组的免疫治疗结果的显著改善有关。高 TMB 和 PD-L1表达50% 或更高的患者对 PD-1/PD-L1抑制的 ORR 高达57% ,低 TMB 和 PD-L1表达低于1% 的患者的 ORR 低至8.7% 。多重免疫荧光和转录组分析显示,高 TMB 水平与增加的 CD8阳性,PD-L1阳性 T 细胞浸润,增加的肿瘤和免疫细胞上的 PD-L1表达,以及先天性和适应性免疫应答特征的上调有关。这些发现表明,增加 TMB 水平与免疫细胞浸润和炎性 T 细胞介导的应答相关,导致 PD-L1表达亚组中 NSCLC 对 PD-1/PD-L1阻断的敏感性增加。
参考文献
1. Xia, C. et al. Cancer statistics in China and United States, 2022: profiles, trends, and determinants. Chin. Med. J. (Engl.) 135, 584–590 (2022).
2. Sholl, L. M. Biomarkers of response to checkpoint inhibitors beyond PD-L1 in lung cancer. Mod. Pathol. 35, 66–74 (2022).
3. Shu, C. A. et al. Neoadjuvant atezolizumab and chemotherapy in patients with resectable non-small-cell lung cancer: an open-label, multicentre, single-arm, phase 2 trial. Lancet Oncol. 21, 786–795 (2020).
4. Cascone, T. et al. Neoadjuvant nivolumab or nivolumab plus ipilimumab in operable non-small cell lung cancer: the phase 2 randomized NEOSTAR trial. Nat. Med. 1–11 (2021) doi:10.1038/s41591-020-01224-2.
5. Dejima, H. et al. Immune evolution from preneoplasia to invasive lung adenocarcinomas and underlying molecular features. Nat. Commun. 12, 2722 (2021).
6. Satpathy, S. et al. A proteogenomic portrait of lung squamous cell carcinoma. Cell 184, 4348-4371.e40 (2021).
7. Ricciuti, B. et al. Association of High Tumor Mutation Burden in Non–Small Cell Lung Cancers With Increased Immune Infiltration and Improved Clinical Outcomes of PD-L1 Blockade Across PD-L1 Expression Levels. JAMA Oncol. (2022) doi:10.1001/jamaoncol.2022.1981.

更多资讯请关注“云准科技”公众号
关于云准
ABOUT US
云准医药科技(上海)有限公司(以下简称:云准)英文名:AccuraMed,用精准和医药相结合。云准成立于2016年,是一家专注于组织生物学标记物检测分析、肿瘤创新药物靶点发现及临床病理免疫诊疗检测方案开发的高科技公司。针对当前热点的肿瘤免疫相关研究致力于为客户提供先进的肿瘤组织免疫微环境分析解决方案。目前我们公司代理Akoya的产品(PhenoCycler平台和PhenoImager平台),并基于此可以提供肿瘤免疫微环境检测相关技术服务。此外云准科技还可以为您提供单细胞+空间多组学技术服务,全方位解析生命的奥秘。云准科技拥有显微切割平台及Thunder活细胞成像平台,为您提供专业的显微切割和Thunder活细胞成像服务。此外我们公司还有配备了3i显微镜成像系统,可以为您提供Marianas LightSheet 成像技术服务和Cleared Tissue LightSheet组织透明化成像服务。此外我们还引进了Agena核酸质谱进行基因分型的检测服务。未来,云准将以创新为驱动力,继续对产品进行深度整合与开发,推动肿瘤免疫、创新免疫疗法和病理诊断技术的突破性发展,必将为肿瘤的诊断和治疗带来革命性变化。